À haute pression, les hydrates de méthane restent « gelés » même si la température dépasse le point de fusion de la glace, comme l'illustre cette « boule de neige en feu ». (©Conseil national de recherches Canada)
À RETENIR
- L’hydrate de méthane est un composé solide, résultat de la cristallisation d’un mélange d’eau et de méthane sous certaines conditions de température et de pression.
- Les hydrates de méthane sont principalement situés dans le pergélisol (couche du sol gelée en permanence, en Arctique par exemple) ou dans les couches sédimentaires des fonds océaniques.
- Les ressources estimées de ces gaz non conventionnels sont très importantes mais leur exploitation n'est pas rentable à l'heure actuelle.
Sommaire
Définition et catégories
L’hydrate de méthane est un composé solide, résultat de la cristallisation d’un mélange d’eau et de méthane sous certaines conditions de température et de pression. C’est une source potentielle d’énergie fossile mais son exploitation s’avère actuellement complexe et coûteuse. Classé avec les gaz non conventionnels (gaz de schiste, gaz de charbon et gaz de réservoir compact), il est localisé principalement dans les régions où se trouve le pergélisol (couche du sol gelée en permanence, en Arctique par exemple) ou dans les couches sédimentaires des fonds océaniques.
L’hydrate de méthane est constitué de molécules de méthane (CH4), entourées par un réseau de molécules d’eau (H2O) disposées en cage, d’où le nom de clathrates (du latin clatatrus, encapsulé), aussi donné aux hydrates. À pression normale et à température ambiante, la cage de molécules d’eau se dissocie et libère une quantité considérable de méthane : lorsque l’hydrate « fond », 1 m³ d’hydrate de méthane peut libérer près de 164 m³ de méthane et de l'eau(1). La part des hydrates dans la production de méthane reste cependant très modeste.
Notons que l’expression « hydrates de gaz » est souvent utilisée pour désigner les hydrates de méthane. Bien que des hydrates puissent se former avec d’autres gaz que le méthane (dioxyde de carbone, hydrogène sulfuré, éthane, butane, propane, etc.), l’amalgame est dû à la prépondérance des hydrates de méthane. Ceux-ci comptent pour 90% des hydrates de gaz naturel.
Fonctionnement technique ou scientifique
Origine du méthane
Le méthane provient de la dégradation de matière organique contenue dans les sédiments, sous le pergélisol ou sous le plancher océanique. Deux catégories se distinguent : le méthane d’origine biogénique et le méthane d’origine thermogénique.
- le méthane dit « biogénique » est issu de la fermentation de matières organiques animales ou végétales, réalisée grâce à des bactéries méthanogènes vivant dans les milieux anaérobies (sans oxygène). Il s’agit de la source principale du méthane contenu dans les hydrates de gaz.
- le méthane dit « thermogénique » est produit à partir de matière organique préservée de la dégradation bactérienne par l’action combinée de la pression et de la température lors de l’enfouissement des sols.
Formation des hydrates de méthane
Le méthane libéré en profondeur migre des sédiments vers la surface sous forme de gaz libre ou dissous dans un liquide proche de la saturation en méthane. Lorsque le méthane atteint une zone de basse température et de forte pression, des hydrates se forment en présence d’eau. Les conditions nécessaires à la stabilité des hydrates de méthane sont rencontrées au niveau des régions de pergélisol ainsi que sous (et à la surface) des fonds océaniques:
- dans le pergélisol : les hydrates de méthane sont présents à partir de 200 m sous la surface terrestre jusqu’à environ 1 000 m. La pression est relativement faible mais la température de surface, atteignant-10°C, est suffisamment basse pour stabiliser les hydrates jusqu’à 1 000 m de profondeur;
- au niveau des fonds océaniques : les hydrates sont localisés à la surface ou sous le fond océanique, généralement à 1 200 m en dessous du niveau de la mer et jusqu’à une profondeur de 1 500 mètres, soit 300 m sous le fond océanique. La température de ce milieu est supérieure à 0°C mais la pression de l’eau sus-jacente crée des conditions favorables à la stabilité des hydrates de méthane.
Les réservoirs potentiels d’hydrates de gaz sont peu profonds sous la surface du sol, en comparaison des gisements conventionnels de gaz naturel le plus souvent situés au-delà de 2 000 m de profondeur.
Méthodes principales de détection des hydrates de méthane
- Par observation directe : de nombreuses localisations d’hydrates de gaz, particulièrement dans les pergélisols, ont été découvertes lors de forages pétroliers ou de gaz naturel, alors que leur présence n’était pas soupçonnée.
- Par détection sismique : la formation des hydrates de gaz sature les sédiments, les imperméabilise et empêche le méthane de migrer vers la surface. Du méthane gazeux s’accumule alors souvent en dessous de la zone de stabilité des hydrates de méthane. La frontière entre la zone contenant les hydrates de gaz et celle contenant du gaz libre est décelable par « réflexion sismique ». On parle de « bottom-simulating reflector » (BSR) et en français de « réflecteur de simulation du fond » (RSF), technique la plus couramment utilisée pour la détection des hydrates de gaz au niveau des fonds océaniques. Toutefois, ces sondages sismiques ne sont pas en mesure d’identifier le lieu optimal de forage, ni d’évaluer la quantité potentielle de gaz. Enfin, l’absence de réflexion sismique ne prouve pas l’absence d’hydrates de gaz.
- Marqueurs géophysiques des sédiments : la formation d’hydrates de gaz altère les propriétés physiques des sédiments, en remplaçant l’eau et/ou le gaz contenus par un composé solide. Ces changements de propriétés peuvent être mesurés lors des forages au moyen d’outils de diagraphie (ensemble d'enregistrements électriques, acoustiques et gammamétriques), induisant la présence d’hydrates. Les données obtenues permettent également de quantifier le volume d’hydrates de méthane. L’étude des marqueurs géophysiques est surtout utilisée dans les puits de forage du pergélisol.
Extraction du méthane
Pour extraire le méthane, les méthodes expérimentales commencent par dissocier (ou « faire fondre ») l’hydrate de méthane en eau et en méthane dans le réservoir lui-même. Le gaz est ensuite récupéré à la surface par l’intermédiaire d’un puits. (Cette méthode est analogue à la production de gaz à partir du charbon).
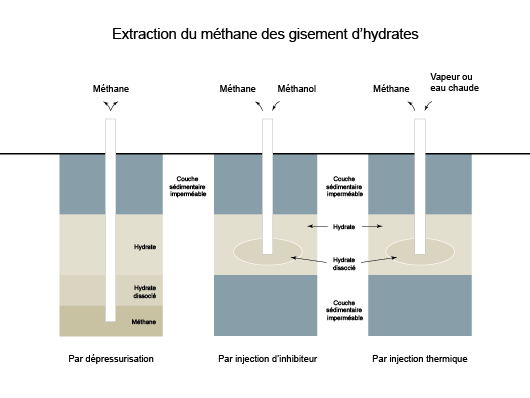
Schéma représentant les trois moyens envisagés pour l’extraction du gaz des gisements d’hydrates (©Connaissance des Énergies, d'après travaux de Christophe Bourry, Ifremer(2))
Trois méthodes d’extraction du méthane sont à l’étude :
- la dépressurisation : elle consiste en un forage à travers une couche d’hydrate piégeant à sa base du méthane. L’extraction du gaz provoque une diminution de pression dans le réservoir, entraînant une dissociation des hydrates par la base et une libération de méthane. Cette technique semble la plus prometteuse. Toutefois, elle se limite aux zones contenant des réserves connues de gaz ;
- l’utilisation d’un inhibiteur : il s’agit de modifier les conditions de stabilité de l’hydrate de gaz en injectant un inhibiteur, comme du méthanol ou du glycol, ou un autre additif. La récupération du gaz par injection d’un inhibiteur est probablement la méthode la plus chère. Par ailleurs, il y aurait un risque sur le plan environnemental en utilisant un produit chimique tel que le méthanol en grande quantité ;
- l’injection thermique de vapeur ou d’eau chaude : cette méthode consiste à envoyer de la vapeur ou de l’eau chaude dans la zone où se trouvent les hydrates pour provoquer leur dissociation en élevant la température. À volume égal de gaz produit, la stimulation thermique est nettement plus chère que la dépressurisation.
Une autre technique proposant un stockage de CO2 suscite l’intérêt. Initiée par le Japonais Ohgaki en 1996, l’idée consiste à extraire du méthane en injectant du CO2 pour le remplacer(3). Ce procédé a fait l’objet de divers programmes d’études, comme le programme allemand SUGAR (2008/2011, puis 2011/2014)(4).
Enjeux par rapport à l'énergie
Selon les estimations de l'EIA américaine, le gaz naturel devrait devenir la deuxième source d’énergie au monde devant le charbon à partir de 2030. Dans ce contexte, les hydrates de méthane apparaissent comme un important contributeur en puissance de la production gazière mondiale. Certes, la combustion des hydrates de méthane émet du CO2, mais de manière équivalente au gaz naturel et en moins grande quantité que le charbon et le pétrole.
Reste que la détection et l’extraction des hydrates s’avèrent complexes et non rentables à l’heure actuelle. L’exploitation des gisements d’hydrates soulève aussi la question de l’impact environnemental.
- Au niveau local : les hydrates jouent le rôle de ciment dans les sédiments des pentes continentales. Lorsqu’ils se dissocient, ils se transforment en un mélange d’eau liquide et de gaz et les sédiments deviennent alors instables. Il y a donc un risque de déstabilisation des pentes, et donc de glissements sous-marins qui peuvent représenter un danger pour les installations et les populations côtières. L’industrie pétrolière y est attentive pour ses projets offshore ;
- Au niveau global : ces composés organiques sont une source de gaz à effet de serre, directement par la production de méthane et indirectement par l’émission de CO2 (issu de la combustion du méthane). Un dégagement de méthane accidentel au cours d’une production commerciale de gaz à partir d’hydrates de gaz présente un risque important, le méthane étant un gaz à effet de serre 28 à 30 fois plus puissant que le CO2 (potentiel de réchauffement global à 100 ans). Un réchauffement climatique, quant à lui, peut potentiellement modifier la stabilité des hydrates de gaz. Cela provoquerait un relâchement de méthane venant renforcer l’effet de serre.
Acteurs majeurs
Les premières extractions d’hydrates de gaz ont eu lieu au Japon et en Russie.
- Japon : en 1995, le ministère du commerce international et de l’industrie du Japon établit le Programme national du Japon sur les hydrates, premier programme majeur à l’échelle mondiale sur les hydrates de gaz. Un programme de recherche (2001-2008) est ensuite mis en place pour localiser et qualifier les ressources sous-marines potentielles du pays. En mars 2009, le Programme sur l'exploitation de l'énergie marine et des ressources marines portant jusqu’en 2016 est voté. La JOGMEC (Japan Oil Gas & Metals National Corporation) est avancée en matière de technologies liées à l'extraction de l'hydrate de méthane. Le groupe a réussi, en 2008, une extraction continue sur le continent en utilisant la méthode de dépressurisation. En 2013, il a réalisé le premier test de production offshore d'hydrates de méthane aux larges des côtes japonaises en produisant près de 120 00 m3 de gaz durant 6 jours (près de 20 000 m3/jour)(5). Le gouvernement japonais prévoit la commercialisation des ressources marines dont l'hydrate de méthane.
- Russie : des hydrates de méthane ont déjà été exploités à Messoyakha (site de Sibérie occidentale, localisé à environ 800 mètres de profondeur), en utilisant la méthode de dépressurisation. Le pays affirme avoir produit 5 milliards de m3 de gaz à partir de ce réservoir depuis 1969(6).
La perspective d’une exploitation industrielle des hydrates de gaz donnent lieu à des collaborations internationales, comme le programme Mallik de production d’hydrates de gaz, rassemblant 5 pays (Japon, États-Unis, Inde, Canada, Allemagne), reconduit en 2007 et 2008.
Des programmes de recherche et développement sont menés également dans plusieurs pays tels que le Chili, la Chine, la Corée du Sud, l’Inde, le Royaume-Uni, l’Allemagne ou les États-Unis. Néanmoins, la part des hydrates dans la production de méthane est encore négligeable.
Unités de mesure et chiffres clés
Les estimations des ressources de méthane contenues dans les hydrates vont de 3 millions à 30 millions de milliards de m3, soit 15 à 150 fois les réserves prouvées de gaz naturel conventionnel(7). Néanmoins, la part des ressources susceptible d’être exploitée dans des conditions économiquement rentables reste difficile à chiffrer et fait encore l’objet de controverses.
Passé
La première découverte des hydrates de gaz date du début du XIXe siècle, lorsqu’en mélangeant de l’eau et du chlore, le physicien et chimiste Humphrey Davy décrit un composé solide au dessus de 0 °C. L’intérêt porté à ces composés entre alors dans le cadre de la recherche fondamentale, portant sur l’identification de leur composition.
Dans les années 1930, pendant l’essor de l’industrie pétrolière et gazière aux États-Unis, les hydrates de méthane sont détectés comme pouvant obstruer les gazoducs. Les recherches se tournent vers l’étude de la formation des hydrates et les moyens de l’éviter dans les pipelines, grâce à la découverte des effets inhibiteurs de certains sels tels le chlorure de calcium, de sodium ou de potassium, ou encore le méthanol.
Les premiers hydrates de gaz naturels découverts dans le permafrost datent de la fin des années 1960 en URSS. Suivent les premières observations d’hydrates en Alaska et au Canada en 1972. La même année, les premiers hydrates de gaz océaniques sont observés par des géologues russes en Mer Noire.
Présent et futur
En 2017, Pékin a annoncé une « avancée historique » suite à des forages réussis en mer de Chine méridionale : la Chine a extrait en 6 semaines plus de 235 000 m3 d'hydrates de méthane depuis les eaux situées à environ 300 km au sud-est de la ville de Zhuhai selon les autorités géologiques nationales. Les experts chinois estiment que cette « glace combustible » pourrait devenir une source d'énergie rentable « autour de 2030 ».
