L'expérience du « bouillant de Franklin » permet de vérifier l'influence de la pression sur la température l'ébullition d'un liquide(2). (©Maël Dancette)
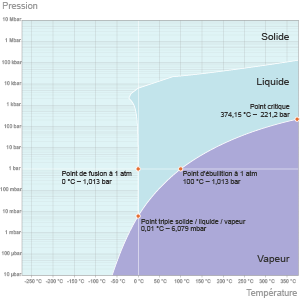
Spontanément, de nombreuses personnes pensent que l’eau bout à 100°C en toute circonstance. Pourtant, cette donnée se vérifie uniquement sous une condition particulière de pression, en l’occurrence sous pression d’1 atmosphère, soit une valeur proche de 1 bar(1). L’eau, comme tous les corps purs, est liquide, gazeuse ou solide selon les conditions de température T mais aussi de pression p auxquelles elle est soumise.
Ce couple pression-température détermine les changements d’état de l’eau qui peuvent être calculés grâce à la formule de Clapeyron (voir diagramme ci-dessous). Une baisse de pression réduit la température d’ébullition de l’eau, une hausse de pression l’augmente.
Par exemple, en haut du mont Blanc où la pression (p = 0,5 bars) diminue de moitié par rapport à la pression atmosphérique, l’eau bout à 85°C, en haut de l’Everest, elle bout à 72°C. L’eau de refroidissement d’un réacteur nucléaire à eau pressurisée (PWR), qui fonctionne autour de 300°C, doit être mise sous une pression de 155 bars pour la tenir loin de l’ébullition. En créant une forte dépression (jusqu’à près de 25 millibars), il est même possible de faire bouillir de l’eau à température ambiante.
Notons que, soumise à une pression de 6 millibars et à une température de 0,01°C, l’eau se trouve simultanément sous trois états différents : solide, liquide et gazeux. Ces conditions particulières correspondent au « point triple de l’eau ».
Une baisse de pression réduit la température d’ébullition de l’eau, depuis son point critique (T = 374°C, p = 220 bars) au-delà duquel liquide et gaz sont indissociables jusqu’à son point triple (T = 0,01°C, p ≈ 6 millibars) au-dessous duquel subsistent seules les phases solides et gazeuses. Entre ces deux points, on passe par l’ébullition classique à 100°C sous un bar de pression. (©2012)